事业什么华海药业生产基地再收警告信 公司称不会对当期业绩产生重大影响
事业什么 界面新闻记者 | 黄华
事业什么 界(👄)面新闻编辑 | 谢欣
事业什么 6月9日,华海药业公告其收到美国食品药品监督管理局(简称“FDA”)的警告信,该警告信系基于今年1月16日至1月24日期间,前述部门对公司位于临海市汛桥镇的药品生产基地(下称“汛桥生产基地”)进行的现场检查。
事业什么 华海药业的公告显示,警告信主要涉及部分口服固(🐕)体生产设备清洁管理、无菌生产区域(🤭)维护和压片剔废参数(🔵)研究的充分性,公司重(🍬)视美国食品(💃)药品监督管理局建议,已积极采取措施进行优化,并持续与其(📈)保持积极沟通。
对于前述事件,华海药业在6月10日接受界面新闻记者采访时表示,目前以公告内容为主。
对于后续影响,华海药业在回复界面新闻记者时表示,本次警告信仅对涉及汛桥生产基地(🕥)的仿制药上市许可申请(ANDA新申请)或补充申请的批准产生影(🈹)响,不会对公司当期业绩产生重大影响。
(💗)二级市场上,6月10日,华海药业股价并未受影响。截至收盘,该公司报21.17元/股,涨7.41%,总市值319.22亿元。

华海药业现阶段已发展为国内大型仿(⛄)制药企,也是国内药品制剂(👽)向美出海的龙头公(👹)司。该公司2024年度(🌀)年报显示,在接近95亿元的年收入中,美国制剂业务销售收入约13亿元,占比超10%。
事业什么 界面新闻记者注意到,美国食品药品监督管理局官网当前公开了一份记录日期为今年4月16日的483表格(注:483表格为美国食品药品监督管理局现场观察报告,内会记录检查发现的不合规信息或缺陷),其中的(⚓)检查日期与地点与华海药业6月9日公告中披露的信息相一致(附图如下(🌜))。

据前述438表格,美(🚟)国食品药品监督管理局的检查员认为,该设备和器具未按适当的时间间隔进行清洁,它有(🚀)可能改变药品的安全、身份、强度、质量或纯度;声称无菌的药品受(🅱)微生(🏴)物污染规程(🏓)缺乏充分验证;缺乏书面程序用于生产和过程控制,以确保药物产品具有它们声称或声称具有的标识、强度质量和纯度,等等。

6月10日,上海某具有多年药品生产质量管理规(🔘)范经验的人员在接受界面新闻记者采访时表示,一般而言,列在美国食品药品监督管(🍂)理局FDA-483表上的缺(👯)陷均属于显著的药品生产质量管理规范(cGMP)问题;比如,药品生产质量管理规范首要目的为“防污染、交(👳)叉污染”,而该公司被查出的诸多设备清洁问题就意味着企业在“防污染、交叉污染”管控方面明显不足。
事业什么 前述人员向界面新闻记者提出,美国食品药品监督管理局开483表的原则为:最(🚸)严重的缺陷列在最前面,所以第1条观察项(Observation)也是该次现场检查中最严重的缺陷。其(🐧)认(🌸)为,这些设备清洁相关的问题也影响(🏮)已销售的产品批次,企业需评估在日常生产中是否也存在相似问题,有哪些潜在交叉污染风险。
在过去,华海药业也(💾)收到警告信,暴露了生产体系中存在的风险。其中,最严重的事件莫过于缬(😊)沙坦杂质事件。据华海药业2019年初公告,缬沙坦杂质事件发生后,美国食品药品监督管理局对公司进行了现场(🍒)检查并对公司川南生产基地出(🤤)具进口(🔜)禁令及(♎)警告信。
事业什么 后在2021年11月,华海药业收到警告信关闭函,意味着该公司已解决(🍹)警告信中提及的相关问题。不过,这一事件对华海药业有持续影响。
据企业2024年度年报,华海药业受缬沙坦杂质事件影响,对缬沙坦产品市(🕋)场召回费用和(🌽)可能承担因缬沙坦原料药(⏲)杂质问题及相关产品断供等给客户造成的损失补偿进行了预计,这笔费用约(⚽)1.5亿元。
事业什么 企业2024年度年报也显示,受缬沙坦杂质事件影响,截至资产负债表日,华海药业尚存在与山(👲)德士的未决仲裁,仲裁事项仍在推进过程中。
相关链接:
- 马斯克被曝炫耀在世界各地都有孩子 滨崎步否认绯闻
- 李斌称蔚来遭受水军抹黑,李云飞坦言“比亚迪受到的攻击和抹黑数倍于蔚来”
- 约 87 款可选:杰克琼斯短袖 / POLO 衫 / 短裤 / 长裤等 62.1 元起官方清仓
- Win11 WSA 项目已终结,微软商店下架相关应用
- 美国恢复处理哈佛国际学生签证 撤销先前禁令
- 荣耀手表 Fit 官宣定档 5 月 28 日:全球首发健康能量评估功能,萌宠表盘吸睛
- 长安汽车朱华荣:坚决反对无道德底线和无法律底线的恶性竞争
- 中国地震局地球物理研究所二级研究员滕云田接受审查调查
- 2025“看中国·外国青年影像计划·辽宁行”展映仪式在大连举行
- 专家点评2025年上海高考数学试卷:难度适中,稳中求新
相关新闻
- 事业什么伊朗“报复性”空袭以色列致数十人伤亡 以持续打击伊机场、核设施等详细阅读

中新社北京6月14日电 综合消息:伊朗13日晚开始对以色列发动“报复性”导弹袭击。据以色列媒体14日报道,袭击造成以至少2人死亡、70人受伤。伊朗...
2025-06-1660
- 事业什么远东宏信:合共2090.5万美元的债券已于6月13日转换并注销详细阅读

远东宏信(03360)发布公告,自2025年6月7日至本公告日期,本金总额合共2090.5万美元的债券(佔债券初始本金总额约6.97%)已于20...
2025-06-1665
- 事业什么台风“蝴蝶”将登陆华南 国家防总办公室、应急管理部持续调度部署防范应对工作详细阅读

中新网6月13日电 据应急管理部网站消息,6月13日,国家防总办公室、应急管理部组织自然资源部、交通运输部、水利部、农业农村部、中国气象局等部门联...
2025-06-1575
- 事业什么【图解牛熊股】稀土概念股涨幅居前,油气开采板块表现强势详细阅读

来源:@财联社APP微博财联社6月15日讯,本周A股三大指数涨跌不一,其中上证指数周跌0.25%,深成指跌0.6%,创业板指涨0.21%。板块方面,...
2025-06-1582
- 事业什么以色列与伊朗冲突升级 埃及领跌中东股市详细阅读
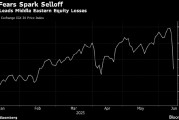
周日,多数中东市场下跌,因以色列与伊朗的报复性攻击引发投资者对冲突扩大的担忧加剧。 自上周五冲突爆发以来,埃及主要股指在首个交易日成为表现最差...
2025-06-1589
- 事业什么用DNA技术鉴定烈士遗骸,让无名烈士不再无名详细阅读

原标题:新发现 用DNA技术鉴定烈士遗骸—— 让无名烈士不再无名 一次偶然的机会,我接触到烈士寻亲这项意义重大的课题。...
2025-06-1589
- 事业什么“若干重大金融政策”即将落定,金融科技能否继续向上突破?详细阅读

周五(6月13日),受外围局势骤变影响,全球资金风险偏好降低,A股科技悉数回调。金融科技板块震荡走低,成份股跌多涨少,共计8股逆市上涨,其中四方精...
2025-06-1591
- 事业什么外资高位清仓杭州银行,累计赚超125亿元详细阅读

6月9日,杭州银行发布两项关键公告:一是外资股东澳洲联邦银行(CBA)清仓所持股份已完成过户,二是该行外籍董事严博(Ian Park)同步辞任。这一系...
2025-06-1596
